Температура плавлення чистої оцтової кислоти, яка практично не містить воду, становить + 16,7 ℃. Тобто, при такій температурі рідка речовина стає кристалічним, дуже нагадує за зовнішнім виглядом звичайний лід. Саме завдяки цій властивості оцтова кислота 96-100% концентрації називається «крижана».
Речовина безбарвно, відрізняється дуже різким запахом. У чистому вигляді практично не застосовується — це небезпечні для здоров’я і життя людей сполуки. Перед використанням в промисловості, кулінарії або побуті крижана кислота обов’язково повинна бути розбавлена водою.
Що таке крижана оцтова кислота
Крижана оцтова кислота (ЛУК) є органічна сполука, одноосновними кислоту , що відноситься до класу карбонових кислот.
Це регулятор кислотності, стабілізатор, зареєстрована офіційно харчова добавка Е260, норми — ГОСТ 61-75.
Області застосування:
Читайте також: Способи заморозки м’яти на зиму і як її можна використовувати
- виробництво кондитерських виробів .
- виготовлення консервів.
- промисловість.
- фармацевтика.
- парфумерія.
Зберігати вдома рідку крижану кислоту небезпечно , так як навіть невелика її кількість при необережному застосуванні може викликати летальний результат.
Формула
Синоніми крижаної оцтової кислоти (формула СН3СООН або С2Н4О2) — метанова кислота, оцтова кислота , ЛУК. Acetic acid glaciad — міжнародна назва. Це ефективний розчинник органічних сполук, який прекрасно поєднується з більшістю розчинників, гігроскопічна, добре розчиняється у воді.
Кваліфікація речовини — «хч», тобто хімічно чистий (вищий ступінь чистоти реактиву, тобто основний компонент міститься в кількості 99% і більше).
ЛУК можна придбати в аптеці без рецепта у вигляді :
- субстанції крижаний 1 кг або 1 м
- субстанції 1 кг.
Отримання
Речовина отримують мікробіологічними (бродіння містять спирт рідин) або хімічним (перегонка деревини) способами.
ЛУК отримують наступними способами :
- Окислення нафтопродуктів — ефективний і найдешевший з існуючих методів.
- Оцтовокисле бродіння. При цьому як сировина використовуються рідини, в складі яких є етанол (соки, вино) і кисень за участю ферментів грибків або бактерій.
- З оксиду вуглецю і ментолу (при промисловому виробництві).
- Реакція Емануеля. Суть методики — окислення н-бутану за участю кобальтового каталізатора, температури +200 градусів Цельсія і тиску 50 атмосфер.
Рекомендуємо: Чи можна додавати оцет при пранні в пральній машині і яка від цього користь
Властивості оцтової кислоти безпосередньо залежать від її концентрації , тобто від вмісту води або домішок.

Концентрація
Застосовується в побуті і харчової промисловості як есенція або оцет. Пояснюється подібне легкістю розведення речовини то потрібної концентрації при знанні правильних пропорцій.
Назви кислоти різні і залежать від концентрації основної речовини :
- оцет — містить від 3 до 15%.
- есенція — від 70 до 80%.
- крижана — є хімічно чистої (без домішок) або містить як мінімум 96% оцтової кислоти.
Властивості
Крижана кислота являє собою кристали або рідина без кольору , має дуже різкий запах, на смак кисла. Закипає при температурі +118,1 градуси Цельсія, плавиться (тобто кристали стають рідиною) при +16,75 градуса Цельсія. Дуже висока температура обумовлює самозаймання ЛУК.
Історія
Оцет є продуктом бродіння вина і відомий людині з давніх часів.
Перша згадка про практичне застосування оцтової кислоти відноситься до III століття до н. е. Грецький вчений Теофраст вперше описав дію оцту на метали, що приводить до утворення деяких використовуваних в мистецтві пігментів. Оцет застосовувався для отримання свинцевих білил, а також ярь-мідянки (зеленої суміші солей міді, що містить крім усього ацетат міді).
В Стародавньому Римі готували спеціально кисле вино в свинцевих горщиках. В результаті виходив дуже солодкий напій, який називали «сапа». Сапа містила велику кількість ацетату свинцю — дуже солодкого речовини, яке також називають свинцевим цукром або цукром Сатурна. Висока популярність сапи була причиною хронічного отруєння свинцем, поширеного серед римської аристократії.
Читайте також: Що можна зробити з морозива: рецепти та поради з приготування
В VIII столітті арабський алхімік Джабір ібн Хайян вперше виклав способи отримання оцту.
за часів Епохи Відродження оцтову кислоту отримували шляхом сублімації ацетатів деяких металів (найчастіше використовувався ацетат міді (II)) (при сухій перегонці ацетатов металів виходить ацетон, цілком промисловий спосіб до середини XX століття ).
Властивості оцтової кислоти змінюються в залежності від вмісту в ній води. У зв’язку з цим багато століть хіміки помилково вважали, що кислота з вина і кислота з ацетатов є двома різними речовинами. Ідентичність речовин, отриманих різними способами, була показана німецьким алхіміком XVI століття Андреасом Лібавіусом (нім. Andreas Libavius) і французьким хіміком П’єром Огюстом Аді (фр. Pierre Auguste Adet).
У 1847 році німецький хімік Адольф Кольбе вперше синтезував оцтову кислоту з неорганічних матеріалів. Послідовність перетворень включала в себе хлорування сірковуглецю до тетрахлорметана з подальшим піролізом до тетрахлоретилену. Подальше хлорування в воді призвело до трихлоруксусной кислоті, яка після електролітичного відновлення перетворилася в оцтову кислоту.
В кінці XIX — початку XX століття більшу частину оцтової кислоти отримували перегонкою деревини. Основним виробником оцтової кислоти була Німеччина. У 1910 році нею було вироблено понад 10 тисяч тонн кислоти, причому близько 30% цієї кількості було витрачено на виробництво барвника індиго.
Вплив оцту на організм людини
Небезпечною для людини дозою служить 1 стакан (200 мілілітрів) навіть звичайного столового оцту, якщо його випити. Крижаний оцтової кислоти вистачить 15 г або 20 мл, есенції — від 20 до 40 мл. При попаданні всередину речовина спалює стінки стравоходу, що супроводжується нестерпним болем.
До хімічного опіку призведе потрапляння на шкіру речовини з концентрацією від 30% і більше . Причому поразки можуть бути різного ступеня тяжкості. ЛУК при контакті з шкірними покривами і слизової провокує незворотний некроз тканин внаслідок коагуляції.
Нейтралізувати руйнівну дію допоможе негайне і рясне промивання ушкодженої ділянки великою кількістю води зі звичайним милом, який вбере кислоту з освітою пластівців. Так відбувається через лужної реакції середовища мила. Після промивання потрібно обробити обпечене місце фурациліном або будь-яким іншим антисептиком.
Увага! Пари крижаний кислоти вкрай небезпечні. Нейтралізувати подразнення дихальних шляхів допоможе полоскання горла, носа, інгаляцій розчином кальцинованої соди (2%).
Скільки допускається вживати оцтової кислоти людині, науці досі не відомо . Випадки погіршення здоров’я людини в результаті дефіциту в раціоні цієї речовини медицині не відомі.
Людям, страждаючим виразкою, гастритом або іншими захворюваннями травного тракту продукти, що містять речовину, вживати не рекомендується, так як воно дратує, а іноді і руйнує слизову. Що зумовлює появу печії, а у важких випадках-опік травного тракту. Рідко, але зустрічається індивідуальна непереносимість.
Рекомендуємо: Рецепти домашніх засобів від комарів — допоможе оцет?
Застосування
Оцтову кислоту, концентрація якої близька до 100% , називають крижаною. 70-80% водний розчин оцтової кислоти називають оцтовою есенцією, а 3-15% — оцтом. Водні розчини оцтової кислоти використовуються в харчовій промисловості (харчова добавка E260
) і побутової кулінарії, а також в консервуванні та для позбавлення від накипу. Однак кількість оцтової кислоти, яку використовують як оцту, дуже мало, в порівнянні з кількістю оцтової кислоти, використовуваної в великотоннажному хімічному виробництві.
Оцтову кислоту застосовують для одержання лікарських і запашних речовин, як розчинник (наприклад, у виробництві ацетилцелюлози, ацетону). Вона використовується в книгодрукуванні і фарбуванні.
Читайте також: Тех.15. Технологічна схема виробництва яєчно-масляних соусів.
Оцтова кислота використовується як реакційна середу для проведення окислення різних органічних речовин. У лабораторних умовах це, наприклад, окислення органічних сульфідів пероксидом водню, в промисловості — окислення пара-ксилолу киснем повітря в терефталевую кислоту.
Оскільки пари оцтової кислоти володіють різким запахом дратівливим, можливо її застосування в медичних цілях у якості заміни нашатирного спирту для виведення хворого з непритомного стану.
Небезпека передозування
Найчастіше в побуті поява опіків провокує 80% есенція, але іноді досить концентрації 30%. Травмування органів зору можна 2% розчином. Для органів дихання небезпечні пари з концентрацією оцтової кислоти 2%. Отруйний пар вдихається легкими, після чого виділяється ними ж, що обумовлює виникнення пневмонії.
Передозування призводить :
- до некротичного нефрозу, при цьому клітини нирок відмирають.
- гострої ниркової і печінкової недостатності.
- геморагії і токсичної дистрофії печінки.
- тканинному некрозу.
При розтині померлої людини кислота легко виявляється завдяки специфічним запахом.
Хімічні властивості
Оцтова кислота має всі властивості карбонових кислот, і іноді розглядається як їх найбільш типовий представник (на відміну від мурашиної кислоти, яка має деякі властивості альдегідів). Зв’язок між воднем і киснем карбоксильної групи (-COOH) карбонової кислоти є сильно полярної, внаслідок чого ці сполуки здатні легко диссоциировать і проявляють кислотні властивості.
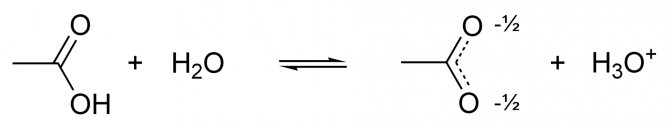
На слабкою дисоціації оцтової кислоти у водному розчині заснована якісна реакція на наявність солей оцтової кислоти: до розчину додається сильна кислота (наприклад, сірчана), якщо з’являється запах оцтової кислоти, значить, сіль оцтової кислоти в розчині присутній (кислотні залишки оцтової кислоти, що утворилися з солі, зв’язалися з катіонами водню від сильної кислоти і вийшло велика кількість молекул оцтової кислоти).
Оцтова кислота здатна взаємодіяти з активними металами. При цьому виділяється водень і утворюються солі — ацетати:
Mg + 2CH3COOH → (CH3COO) 2Mg + H2 ↑
Оцтова кислота може хлоруватися дією газоподібного хлору. При цьому утворюється хлоруксусная кислота:
CH3COOH + Cl2 → CH2ClCOOH + HCl
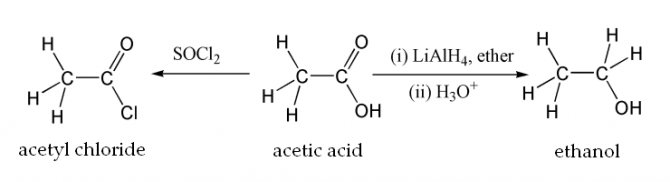
Оцтова кислота може бути відновлена до етанолу дією алюмогідріда літію. Вона також може бути перетворена в хлорангидрид дією тіонілхлориду. Натрієва сіль оцтової кислоти декарбоксилируется при нагріванні з лугом, що призводить до утворення метану і карбонату натрію.
Особливості застосування крижаної оцтової кислоти
ЛУК застосовується як водний розчин з різною концентрацією при друкуванні книг , виробництві текстилю, як реагент і розчинника.
Використання :
- Виробництво ліків (фенацетин, аспірин), барвників, інсектицидів, оцтового ангідриду .
- При виготовленні консервів, маринадів, приправ, оцту, есенції.
- у парфумерної промисловості.
- Як коагулянт латексу, протрава в процесі фарбування, розчинник лаків.
у побуті речовина використовується для видалення з одягу плям від ягід, фруктів, неприємного, затхлого запаху в хлібниці (досить протерти її стінки розчином), забруднень на дзеркалах і стеклах. Після протирання ватними дисками, змоченими в розведеною кислоті засмальцьованих ділянок на вовняних речах, волокна тканини відновлюються, а жирність зникає. Скляні та дзеркальні поверхні після обробки розчином починають блищати.
В народній медицині
ЛУК застосовується в якості прижигающего і муміфікують кошти при видаленні мозолів, бородавок і інших доброякісних уражень шкірного покриву.
Розведена крижана кислота надає дію :
- протипротозойну.
- протимікробну.
- протигрибковий.
Оцтові компреси в народній медицині широко застосовуються як засіб, що знижує температуру тіла.
Водний розчин застосовується :
Читайте також: Як приготувати страви з заморожених печериць
- Для усунення неприємних симптомів після укусу комах (комарів, бджіл). Місце укусу треба змастити ватним диском, змоченим в складі.
- При лікуванні педикульозу.
- Як засіб знищення хвороботворних мікроорганізмів в приміщенні, де знаходиться хворий людина (буде потрібно розпорошити оцет в повітрі за допомогою пульверизатора).
- Якщо обгорілу під прямими сонячними променями або обпалену медузою шкіру змастити засобом, то печіння і свербіж практично зникнуть.
- Можливо застосування при лікуванні фарингітів, ревматизму, артриту, ангін, кандидозу.
Важливо! Лікуватися крижаний кислотою самостійно категорично заборонено! План заходів повинен призначити лікар.
Як лікарський засіб ЛУК всередину не приймається . До ХХ століття 5% розчин використовувався в боротьбі з ожирінням. Дія грунтувалося на роздратуванні органів травлення (аж до опіку), в результаті чого поживні речовини не засвоювалися. Люди дійсно худнули, але за це вони розплачувалися здоров’ям.
Рекомендуємо: Як правильно розводити оцет: інструкція як зробити 5 відсотковий з 70%
В косметології
Завдяки властивості знищувати мікроби речовина використовується при лікуванні прищів. Крім того, воно ефективно:
- при боротьбі із зайвою вагою і целюлітом (обгортання).
- як засіб позбавлення від лупи.
- захищає від втрати волосся (оцет в поєднанні з листочками кропиви і коренем лепехи).
- для повернення блиску локонам (ополіскування чистих волосся слабким розчином).
Важливо! Вживання великої кількості оцту заборонено. Концентровані розчини взагалі протипоказано приймати всередину, так як доза 20 мл вже є смертельною для людини.
Існують правила обережності при використанні та зберіганні оцтової кислоти :
- Перед роботою з речовиною необхідно надіти на руки рукавички.
- Зберігання допустимо виключно в недоступних для дитини місцях.
- Використовувати засіб дозволяється тільки в добре провітрюваних приміщеннях. В іншому випадку можливе пошкодження органів дихання парами.
- При попаданні на шкірні покриви потрібно негайна обробка ураженої ділянки складом з води, мила і соди.
- Після потрапляння оцтового розчину потрібно ретельне і тривале промивання очі.
Кислота роз’їдає гумові частини побутових приладів . Наприклад, якщо в пральну машинку залити концентрований розчин, то гумка, яка перебуває поруч з барабаном порветься.
Отримання
В промисловості
Ранніми промисловими методами отримання оцтової кислоти були окислення ацетальдегіду і бутану.
Ацетальдегід окислявся в присутності ацетату марганцю (II) при підвищеній температурі і тиску. Вихід оцтової кислоти становив близько 95% при температурі + 50- + 60 ° С.
2CH3CHO + O2 ⟶ 2CH3COOH
Окислення н-бутану проводилося при 150 атм. Каталізатором цього процесу був ацетат кобальту.
2C4H10 + 5O2 ⟶ 4CH3COOH + 2H2O
Обидва методи базувалися на окисленні продуктів крекінгу нафти. В результаті підвищення цін на нафту обидва методи стали економічно невигідними, і були витіснені більш досконалими каталітичними процесами карбонилирования метанолу.
Каталітичне карбонилирования метанолу
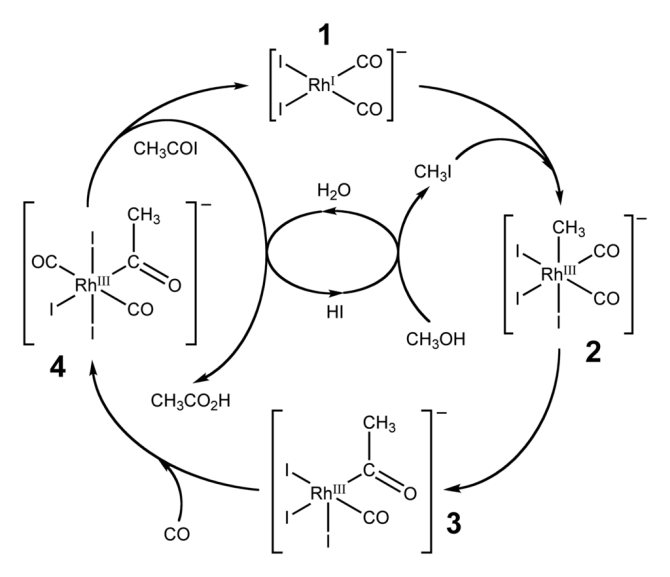
Важливим способом промислового синтезу оцтової кислоти є каталітичне карбонилирования метанолу моноксидом вуглецю, яке відбувається за формальною рівняння:
CH3OH + CO ⟶ CH3COOH
Реакція карбонилирования метанолу була відкрита вченими фірми BASF в 1913 році. У 1960 році ця компанія запустила перший завод, що виробляє оцтову кислоту цим методом. Каталізатором перетворення служив йодид кобальту. Метод полягав в барботаже монооксиду вуглецю при температурі 180 ° С і тиску 200-700 атм через суміш реагентів. Вихід оцтової кислоти становить 90% по метанолу і 70% по СО. Одна з установок була побудована в Гейсмара (шт. Луїзіана) і довго залишалася єдиним процесом BASF в США.
Удосконалена реакція синтезу оцтової кислоти карбонілюванням метанолу була впроваджена дослідниками фірми Monsanto в 1970 році. Це гомогенний процес, в якому використовуються солі родію в якості каталізаторів, а також йодид-іони в якості промоторів. Важливою особливістю методу є велика швидкість, а також висока селективність (99% по метанолу і 90% по CO).
В такий спосіб отримують трохи більше 50% всієї промислової оцтової кислоти.
В процесі фірми BP в якості каталізаторів використовуються сполуки іридію.
Біохімічний спосіб виробництва
При біохімічному виробництві оцтової кислоти використовується здатність деяких мікроорганізмів окисляти етанол. Цей процес називають оцтовокислим бродінням. В якості сировини використовуються етанолвмісних рідини (вино, заграв соки), або ж просто водний розчин етилового спирту.
Реакція окислення етанолу до оцтової кислоти протікає за участю ферменту алкогольдегідрогенази. Це складний багатоступінчастий процес, який описується формальним рівнянням:
CH3CH2OH + O2 → CH3COOH + H2O
Гідратація ацетилену в присутності ртуті і двовалентних солей ртуті
C2H2 + H2O → Hg2 + CH3CHO — Реакція Кучерова CH3CHO → CrO3, H2SO4 CH3COOH