Лужні метали — представники хімічно активних неорганічних речовин : калій, натрій, літій, цезій, рубідій, францій. Їх широко використовують в побуті, техніці, різних промислових і наукових областях, виробництві інших металів і сплавів: в джерелах струму, акумуляторах. в протигазах і дихальних апаратах. в оптичних приладах, збройових прицілах нічного бачення. в складі лікарських засобів. в ролі каталізаторів хімічних процесів. ізотопи цезію входять до складу засобу для стерилізації медичних інструментів. з’єднання рубідію використовують не тільки в хімічній, але і в атомній промисловості.
Метали цієї групи дуже небезпечні , так як здатні займатися просто від контакту з водою або киснем повітря, тому працювати з ними потрібно дуже обережно і зберігати в особливих умовах.
Які чинники впливають на термін зберігання
Зіткнення лужних металів з вологою призводить до бурхливої хімічної реакції , виділенню великої кількості тепла, розігріву речовин і виділення водню, в результаті можливе займання або навіть вибух. При цьому утворюються лугу — дуже активні сполуки, що викликають опіки. Тому небезпечно утримувати лужні метали в приміщеннях з підвищеною вологістю .
Для роботи з такими агресивними речовинами необхідний витяжна шафа , оббитий всередині сталевими листами, піддон з азбестовим килимком, далеко від джерела вологи і вогню. Чи безпечно зберігати такі метали, залитими зневоднених трансформаторним маслом або гасом, щоб не допустити контакту чистого металу з повітрям.
Дуже легкий літій в гасі спливає на поверхню, тому його додатково притискають сіткою або зберігають під шаром вазеліну, парафіну.
Читайте також: Тісто для ліплення — для дітей заміна пластиліну: кращі рецепти. Як зробити солоне тісто для ліплення виробів в домашніх умовах
Гас , застосовуваний для зберігання в ньому активних металів, необхідно періодично перевіряти на вологість. Для цього до невеликої кількості випробуваного гасу додають шматочок натрію. Якщо не з’явилися пухирці газу (водню), гас вважається якісним.
Тара після лужних металів знешкоджується етиловим спиртом. Відходи та обрізки металів необхідно збирати в окремі банки з гасом для подальшої утилізації.

Непотрібні залишки калію і натрію не слід накопичувати більше 2 грам , а утилізувати в той же день. Спочатку відходи потрібно розчинити в етиловим спирті, доливаючи його невеликими порціями. Отриманий розчин сильно розбавляють водою і тільки після цього вже можна зливати в каналізацію.
Якщо умови зберігання не дотримувалися і сталося загоряння, гасити слід сухим піском або за допомогою порошкового вогнегасника. Воду застосовувати в цьому випадку не можна.
Робота з лужними металами. Джерела небезпеки
Лужні метали широко застосовуються в лабораторіях як реагенти для синтезу та аналізу, активних відновників, а також осушувачів для органічних розчинників. Ці метали відносяться до найбільш активних елементів, що обумовлює їх високу вогнестійкість, а також агресивність по відношенню до тканин організму. Надзвичайно небезпечні опіки розплавленими лужними металами. Термічні опіки в цьому випадку посилюються важкими хімічними опіками. Будь-які операції з дисперсіями лужних металів, а також з металевим калієм справедливо вважаються одними з найнебезпечніших робіт в хімічній лабораторії.
Всі ці метали подібні за своїми фізико-хімічними властивостями. Однак для розробки конкретних запобіжних заходів при роботі з ними недостатньо знати їх загальні властивості. Тому розглянемо властивості кожного лужного металу окремо і пов’язані з цими властивостями джерела Небезпеки [8].
Літій (щільність 0,534 г / см3, температура плавлення 180,5 ° С). Поширеною помилкою в лабораторній практиці є надооценка небезпеки, яку представляє металевий літій. Дійсно, реакційна здатність літію істотно нижче, ніж калію і натрію. Однак ступінь небезпеки того чи іншого речовини не завжди знаходиться в прямій залежності від його хімічної активності, і в деяких відносинах літій небезпечніше натрію. Тушенце палаючого літію, наприклад, представляє набагато серйознішу проблему, ніж гасіння натрію і навіть калію.
При роботі з літієм слід враховувати, що він володіє найменшою щільністю з усіх твердих і рідких речовин. Літій, на відміну від калію і натрію, спливає в будь-якому органічному розчиннику. Тому його не можна зберігати в гасі або рідкому маслі. Сприятливим середовищем для зберігання літію служить вазелін або парафін.
При нормальній температурі літій повільно взаємодіє з киснем повітря. При підвищенні температури реакція йде більш бурхливо, і при температурі вище точки плавлення метал може самозапалившись. Присутність оксиду або нітриду сприяє самозаймання.
Іноді взаємодія тонкої суспензії літію з галогеналкіламі і галогенаріламі (наприклад, при отриманні феніллітія з бромбензол в ефірі) протікає, після деякого індукційного періоду-надзвичайно бурхливо. Вважають, що такий перебіг реакції може бути пов’язано з наявністю на частинках металу оксидної плівки, яка зникає в результаті хімічної реакції або при перемішуванні, оголюючи відразу велику поверхню металу.
Читайте також: Чим відрізняється пастеризоване і стерилізоване молоко: розбираємося в технології
Літій використовують для відновлення деяких металів з їх оксидів. Після ініціювання при помірній температурі реакція протікає бурхливо. Взаємодія оксиду хрому (III) з літієм починається при 180 ° С, а в ході реакції суміш розігрівається до 965 ° С. Нижче наведені початкова і кінцева температури при взаємодії літію з деякими оксидами:
Оксид Температура 1. ° С: початкова кінцева Мо203 180 1400 n02o5 320 490 ТЮ2 200-400 1400 v2o5 394 768
Відновлений таким способом метал містить надлишок літію, тому залишена на повітрі маса іноді запалюється.
Натрій (щільність 0,97 г / см3, температура плавлення 97,7 ° С). Внаслідок високої хімічної активності натрію робота з ним в лабораторії є серйозною небезпекою. У той же час натрій широко застосовується для абсолютування вуглеводнів і простих ефірів. Часта робота з ним призводить до відомого психологічного ефекту — адаптації до небезпеки [29]. Навіть досвідчені працівники іноді грубо порушують правила поводження з металевим натрієм. Щорічно з цієї причини в хімічних лабораторіях відбувається значне число вибухів і пожеж.
Натрій взаємодіє з киснем повітря при кімнатній температурі з утворенням оксиду. Реагуючи з вологою повітря, оксид переходить в гідроксид. Шматки натрію, залишені на повітрі, швидко обростають розпливається кіркою гідрокси-да. Такі шматки помилково можуть бути прийняті за один із зазвичай застосовуваних осушувачів. При митті посуду водою в таких випадках іноді відбуваються вибухи, які особливо небезпечні через їх несподіванки. До того ж лаборанти при митті посуду нерідко працюють без очок. Щоб уникнути нещасних випадків слід знищувати залишки натрію відразу після їх утворення. У вологому повітрі чималі шматки через деякий час можуть спалахнути. Дисперсії металевого натрію в вугіллі "-водородах негайно спалахують на повітрі при видаленні розчинника.
Співробітник А. виконував роботу, пов’язану з отриманням та використанням дисперсії металевого натрію в органічному розчиннику. До атого йому неодноразово доводилося працювати з лужними металами, проте з необхідністю отримання дисперсії він зіткнувся вперше. В оригінальній статті, звідки співробітник запозичив методику роботи, нічого не говорилося про підвищену небезпеку дисперсій лужних металів, вказувалося лише, що всі маніпуляції необхідно проводити в аргоні.
Співробітник приготував дисперсію натрію в толуолі в колбі місткістю 200 мл під аргоновой «подушкою», потім вилив в струмі аргону отриману дисперсію в літрову реакційну колбу і відклав порожню колбу на піддон для брудного посуду, що стояв поряд з установкою в витяжній шафі. Він зауважив, що на стінках і горлі колбочки залишився наліт мелкораздробленного натрію, і збирався обполоснути її спиртом. Однак відразу ж, як тільки в колбу потрапило повітря, стався спалах. Співробітник інстинктивно відсмикнув руки і при цьому впустив крапельну воронку, яка містить 200 мл органічного розчинника. Воронка розбилася, розчинник запалав, вогонь охопив реакційну колбу. На щастя колба не розбилася і пожежу вдалося порівняно швидко ліквідувати за допомогою вуглекислотних вогнегасників.
При аналізі події з’ясувалося, що співробітник не знав про те, що дисперсії натрію миттєво спалахують в повітрі. За три місяці до цього він здав іспит з техніки безпеки, однак в інструкції по роботі з лужними металами не були згадані властивості дисперсії. Під час попереднього обговорення роботи з керівником працівник не інформував його про те, що збирається замінити яка зазвичай використовується натрієву дріт дисперсією, вважаючи це несуттєвою деталлю.
Теплоти реакції часто буває досить для займання утворюється водню. При розчиненні невеликих шматочків натрію в холодній воді (нижче 40 ° С) займання, як правило, не відбувається. Однак, якщо рухливість шматочків натрію обмежена (наприклад, вони можуть очікувати в в’язкий розчин або на мокру фільтрувальний папір), займання неминуче. Особливо небезпечний контакт натрію з водою в умовах, коли виділяється водень накопичується в обмеженому обсязі, наприклад при попаданні води в колбу з залишками натрію. наслідком зазвичай буває вибух повітряно-водневої суміші. При контакті натрію з льодом відбувається вибух.
Присутність води в спирті значно прискорює реакцію. Взаємодія етилового спирту, що містить більше 5% води, з натрієм небезпечно. При реакції натрію з спиртами слід також вживати заходів проти утворення вибухонебезпечної повітряно-водневої суміші.
Студент-дипломник Л. збирався знищити залишки натрієвої дроту в пляшці з-під розчинника. Тримаючи пляшку в руках, він налив у неї невелика кількість етилового спирту. Реакція виявилася надзвичайно бурхливої, натрій відразу ж розплавився, пляшка сильно розігрілася. Л. поставив пляшку в раковину і відскочив убік. Від зіткнення з холодною водою пляшка тріснула, кілька кульок розплавленого натрію потрапило в раковину і потім через зливну грати — в каналізаційну трубу. Через кілька секунд пролунав вибух, який зруйнував чавунний сифон. Ніхто з прісутствующіх’не постраждав.
При розслідуванні події з’ясувалося, що працювали в лабораторії студенти і співробітники регулярно знімали УФ-спектри в 96% етиловому спирті. Відходи спирту зливалися в ємність з написом «Зливи етанолу (після УФ-спектрів)» і зазвичай використовувалися для технічних цілей, головним чином, для знищення відходів натрію. За день до події, з дозволу викладача, в кімнаті працювала студентка з іншої лабораторії -Знімаються УФ-спектри в водно-спиртовому розчині. Після закінчення роботи вона без відома співробітників вилила залишки розчинів в ємність для зливів. Аналіз солепжімого пляшки ппкячял що Л., не знаючи того, використовував для знищення натрію фактично 50% водно-спнртовий розчин.
Примітно, що особами, які мають отношеніенк аварії, фактично не було допущено будь-якого серйозного порушення правил . Однак всі вони в тій чи іншій мірі проявили недостатню обачність. В результаті сталася аварія, наслідки якої могли бути набагато серйознішими.
З гарячим гліцерин-му натрій реагує бурхливо, що виділяється водень негайно загоряється, тому використання гліцеринових бань для нагрівання установок, що містять натрій, не менш небезпечне, ніж використання водяних бань.
З діоксидом вуглецю, на відміну від літію, натрій не реагує аж до температури червоного розжарювання. Однако- загорівся натрій продовжує горіти після витіснення повітря діоксидом вуглецю, причому інтенсивність горіння збільшується. Контакт твердого діоксиду вуглецю (сухого льоду) с. натрієм призводить до сильного вибуху.
На відміну від літію, натрій не реагує з азотом, горіння металу в атмосфері азоту припиняється.
Читайте також: Як правильно містити дощових черв’яків в ящиках: розведення в домашніх умовах
Суміші натрію з галогенопохідних вуглеводнів, за винятком повністю фторованих, вибухають від удару або стиснення, а також при підвищенні температури. Мелкораздробленного натрій взаємодіє з нерозбавленими галоген-алкіл і галогенаріламі з вибухом. Критичним фактором при взаємодії натрію з галоген-похідними вуглеводнів служить температура. Так, при отриманні бутілбензола по реакції Вюрца з бромбензол і 1-бромбутана в присутності натрію в середовищі ефіру при температурі нижче 15 ° С реакція майже не йде. Вище 15 ° С реакція йде досить активно, а вище 30 ° С виходить з-під контролю [64].
В літературі є повідомлення і про непередбаченому перебігу реакцій. Так, невелика проба (близько 1 г) перфторгексіліодіда не реагував при кипінні (114 ° С) з натрієм, а суміш 140 г зазначеного йодиду і 7 г натрію вибухнула через 30 хв [59]. Слід дотримуватися обережності під час сплаву органічних сполук з натрієм при виконанні якісного аналізу. Наявність галогенопохідних в пробі
Отримання амальгами натрію шляхом прямого контакту з ртуттю супроводжується значним виділенням теплоти. При відсутності. запобіжних заходів температура може досягти 400 ° С. Щоб уникнути вибухів і розбризкування ртуті взаємодія слід або проводити під шаром інертного захисної рідини, наприклад толуолу або мінерального масла, або поступово додавати ртуть до натрію з крапельної воронки.
Дисперсії натрію в ефірі, толуолі або тетрагідро-фуранів застосовуються для відновлення багатьох металів з їх галогенідів. Отримувані таким способом порошки кадмію, хрому, кобальту, міді, заліза, марганцю, молібдену, нікелю, алюмінію, олова, цинку, Індія, магнію та інших металів мають високу хімічну активність і пірофорному. Суміші натрію з галогенідами металів чутливі до удару. При цьому хлорид і бромід заліза (III), бромід і йодид заліза (II), хлорид і бромід кобальту (II) викликають дуже сильні вибухи. Сильні вибухи дають суміші натрію з галогенідами алюмінію, сурми, миш’яку, вісмуту, міді (II), ртуті, срібла, свинцю, а також з пентахлоридом ванадію. Хлорид алюмінію, галогеніди міді (1), кадмію, нікелю дають слабкі вибухи. Суміші натрію з галогенідами лужних і лужноземельних металів вибухобезпечні.
Чутливі до удару суміші натрію з органічними сполуками, що містять нітрогрупи, наприклад з нітрометаном, нітробензолом, динітробензол, дінітронафталіном, етил-нітритом, етілнітратом, трінітрогліцеріном і ін. Вибухонебезпечна ™ сумішей підвищується зі збільшенням числа нітрогрупп.
Безводні хлороводород, фтороводород і сірчана кислота повільно реагують з натрієм. Контакт водних розчинів кислот з металом викликає вибух.
Калій (щільність 0,87 г / см3, температура плавлення 63,7 ° С). За хімічними властивостями калій схожий з натрієм, а за активністю перевершує його. У всіх відношеннях калій являє набагато серйознішу небезпеку, ніж натрій.
У вологому повітрі окислювання йде настільки швидко, що метал розплавляється і може спалахнути, особливо при локальному застосуванні тиску і оголенні свіжої поверхні, наприклад при видавлюванні дроту.
При тривалому контакті з повітрям шматки калію покриваються щільною кіркою надпероксида калію з проміжною прошарком з оксиду.
Взаємодія надпероксида калію зі здібними окислюватися органічними або неорганічними речовинами настільки активно, що може супроводжуватися вибухом. Вибух можливий вже при простому зіткненні органіческіx речовин з сильно окислів шматками калію.
При зрізанні кірки оксидів з шматків калію нерідко відбувається займання або навіть вибух. Хоча контакт свежеочіщенной поверхні ‘калію з чистим надпероксида калію призводить тільки до займання після деякого індукційного періоду, присутність слідів води, домішок вуглеводневих розчинників або мінерального масла значно збільшує ймовірність вибуху.
Старі, сильно окислилися шматки калію, у яких кірка оксидів пофарбована в жовтий або жовто-оранжевий колір, використовувати не можна. Вони повинні бути знищені додаванням невеликих порцій грег-бутилового спирту в фарфоровому стакані під шаром ксилолу.
Взаємодія калію навіть з холодною водою протікає настільки бурхливо, що виділяється водень негайно загоряється. При контакті великих шматків калію з водою відбувається вибух, дрібні бризки палаючого розплавленого металу розлітаються (іноді в радіусі кількох метрів), викликаючи вторинні осередки загоряння, а при попаданні на шкіру — дуже небезпечні опіки: Вибухають і дрібні шматочки калію в разі їх контакту з обмеженим кількістю води, наприклад при попаданні на вологі поверхні.
З спиртами калій реагує набагато енергійніше, ніж натрій. Спроби отримання алкоголятов шляхом додавання калію до спиртів (включаючи октанол, бен-Зілов спирт, циклогексанол) призводять до вибуху, якщо повітря з реакційного судини ні попередньо витіснений азотом або аргоном. Вносити калій в спирти рекомендується дуже невеликими порціями при перемішуванні, обов’язково контролюючи температуру маси. Додавати чергову порцію калію слід тільки після охолодження розчину. Необхідно повністю виключити можливість потрапляння шматочків калію в охолоджуючу баню: при контакті калію зі снігом або льодом відбувається .взрив.
Сдіоксндом вуглецю калій реагує аналогічно натрію. З оксидом вуглецю СО, на відміну від натрію, калій легко реагує з утворенням вибухонебезпечного карбонила. Реакція йде вже при — 50 ° С, продуктом її є дікарбоннл калію КС2О2. При контакті з повітрям або водою, а також при нагріванні до 100 ° С останній вибухає. Калій легко реагує з різними, формами вуглецю — сажею, графітовим порошком, активним вугіллям. При підвищених температурах реакція протікає досить бурхливо. Якщо вуглець знаходиться в дрібнодисперсному стані, взаємодія його з калієм у присутності повітря може відбуватися з вибухом. Головну роль при цьому грає, очевидно, реакція утворюється надпербксіда калію з вуглецем. Вибухи можуть відбуватися також при спробах погасити палаючий калій графітовим порошком, який нерідко рекомендують в якості огнегасительного кошти, що неправильно.
З галогенпроізво’днимі вуглеводнів калій утворює вибухонебезпечні суміші, які ще більш чутливі до удару і нагрівання, ніж суміші з натрієм. Вибухонебезпечність підвищується зі збільшенням числа атомів галогену в молекулі. Так, суміш калію зчотирьоххлористим вуглецем в 150- 200 разів чутливіші до удару в порівнянні з гримучої ртуттю, а суміш калію з бромоформ вибухає від нікчемного струсу. Суміші з тетра-і пентахлоретаном схильні вибухати мимовільно. Взаємодія калію з галогенопохідних вуглеводнів в інертних розчинниках піддається контролю при точному дотриманні умов реакції, зокрема температурного режиму, проте слід строго стежити за тим, щоб поверхня металу була свежеочіщенной — наявність навіть слідів оксидів призводить до непередбачуваного перебігу реакції.
З галогенидами. багатьох металів калій реагує аналогічно натрію, але більш енергійно.
Багато органічні і неорганічні сполуки, що містять н Ітро груп п у, ‘наприклад нітрат амонію, пікринової кислота, нітробензол, будучи нечутливі до удару самі по собі, стають надзвичайно вибухонебезпечними в присутності навіть слідів калію або калій-натрієвого сплаву.
Сплав калій-натрій. Сплав містить 50-85% (по масі) калію, температура його плавлення нижче кімнатної. Хімічна активність сплаву аналогічна активності калію, проте в зверненні він ще небезпечніше. Будучи рідким при кімнатній температурі, сплав набуває з реагентами в більш тісний контакт, ніж твердий метал, тому реакції йдуть ще енергійніше. При контакті з повітрям сплав негайно запалюється, так як легко випливає з оксидної плівки, оголюючи свіжу поверхню металу. Суміш сплаву з твердим д і про кс і до м вуглецю в 40 разів чутливіша до удару в порівнянні з гримучої ртуттю. Не рекомендується використовувати сплав для відновлення металів з галогенідів в тих випадках, коли сіль добре розчиняється у використовуваному розчиннику (наприклад, ZnCh або FeCl3 в тетра-гідрофуране), оскільки реакція може бути занадто бурхливої.
Знищення залишків лужних металів
Відходи літію. Обрізки та невеликі (не більше горошини) шматочки літію можна знищити шляхом розчинення у великій кількості холодної води в витяжній шафі.
Дисперсії літію з огляду на їх високою реакційною, здатності не можна розчиняти в воді. Залишки дисперсії в вуглеводневому розчиннику знищують поступовим додаванням етилового спирту.
Відходи натрію. Обрізки та залишки дроту в кількості не більше 5-10 г негайно знищують, заливаючи їх у фарфоровому стакані невеликими порціями етилового спирту до повного розчинення. Допускається використання ізопропілового спирту, що містить до 2% води для прискорення реакції. Існує спосіб знищення невеликих шматочків натрію в колбі з холодною водою. Поверх води наливають шар бензину товщиною 3-5 см. Шматочки натрію по одному опускають у колбу. Черговий шматочок вносять тільки після повного розчинення попереднього. Натрій розчиняється на кордоні розділу фаз, захисний шар бензину перешкоджає запаленню водню. Спосіб зручний, проте з точки зору безпеки не має переваг перед загальноприйнятими методами.
Необхідно стежити за повнотою розчинення натрію при обробці етиловим спиртом шламів після проведення реакцій: Так, надлишок натрію після реакції Вюрца не завжди вдається повністю знищити спиртом , оскільки шматочки натрію бувають покриті кіркою галогенідів, нерозчинних в спирті. Подальше промивання водою в таких випадках призводить до займання маси.
Дисперсії натрію розкладають додаванням по краплях безводного спирту без доступу повітря.
Читайте також: Що можна приготувати з виноградного листя крім долми
Відходи калію. Ці відходи знищують, заливаючи їх сумішшю рівних кількостей петролейного ефіру і безводного ізопропілового спирту. Знищення залишків калію за допомогою етилового спирту є порушенням правил техніки безпеки. Обрізки калію можна розкладати в фарфоровому стакані в витяжпеткой з такою швидкістю, щоб реакція була не дуже бурхливою. Б випадку займання стакан накривають заздалегідь приготованим шматком азбесту.
Не допускається збір обрізків калію і натрію в одну ємність. При контакті двох металів утворюється сплав, який при певному співвідношенні компонентів стає рідким при кімнатній температурі, що значно підвищує небезпеку роботи з ним. Особливо небезпечно знищувати сильно окислилися шматки калію в разі ,. якщо кірка оксидів має жовту ‘забарвлення. Навіть з Гретою-бутіловим спиртом реакція може протікати дуже бурхливо. Знищення проводять в фарфоровому стакані під шаром ксилолу, додаючи по краплях грег-бутиловий спирт. Операцію здійснюють у вільному витяжній шафі при закритих стулках, маючи напоготові засоби пожежогасіння.
Великі кількості лужних металів. Знищення великих кількостей іноді рекомендується проводити шляхом спалювання на відкритих майданчиках. Однак такі рекомендації не можна визнати обгрунтованими. При горінні лужних металів на повітрі утворюються аерозолі гідроксидів у вигляді диму, що призводить до забруднення навколишнього середовища. Спалювати лужні метали можна тільки в спеціальних печах, обладнаних системами подачі повітря і очищення газів, що відходять.
При правильній організації роботи в лабораторії, коли обрізки не накопичуються, а знищуються своєчасно, не виникає необхідності знищення великих кількостей лужних металів.
Очищення лужних металів від оксидних плівок
Оксидні плівки з поверхні шматків літію і натрію рекомендується видаляти гострим ножем під шаром ксилолу або мінерального масла, попередньо висушених над натрієвої дротом. Операцію зручно проводити в порцеляновій ступці. Очищені шматки металу переносять пінцетом в счакан або колбочку з висушеним ксилолом. Обрізки металу після обережного Декантірованіе ксилолу негайно знищують. Пій очищення калію ця методика не може вважатися безпечною, хоча і рекомендується в деяких посібниках. При контакті свіжої поверхні калію з оксидною плівкою іноді відбуваються вибухи навіть під шаром захисної рідини.
Набагато безпечніше, економічніше і простіше спосіб очищення калію, що полягає в плавленні металу під шаром висушеного гептана. Невеликі неочищені шматки (близько 20 г) плавлять в широкогорлой колбі Ерленмейера або у високій склянці. Після розплавлення металу нагрівання припиняють і акуратним обертанням колби домагаються того, щоб калій витік з оксидних плівок. Якщо необхідні більш дрібні шматки, обережним струшуванням колби або скляною паличкою розбивають порцію на кілька глобул. Далі колбу охолоджують і коли метал твердне, виймають глобули за допомогою гострої залізної палички або довгого пінцета і переносять в тарований бюкс з гептаном лля подальшого зважування. Решта плівки підлягають негайному знищенню:
Описана методика придатна і для очищення натрію. У цьому випадку замість гептана використовують висушений ксилол.
Не можна різати лужні метали на повітрі, навіть якщо не потрібно збереження блискучій поверхні — це небезпечно.
абсолютований органічних розчинників
Більша частина аварій і нещасних випадків, пов’язаних з металевим натрієм, відбувається при його використанні в якості осушувача.
абсолютування натрієм проводиться настільки часто, що навіть досвідчені працівники іноді забувають про обережність. Крім того, цю операцію нерідко доручають лаборантам, не проводячи детального інструктажу.
Натрій можна застосовувати для абсолютування тільки вуглеводнів і простих ефірів. Як правило, не можна використовувати натрій для сушки кислот, складних ефірів, спиртів, галогенопохідних жирного і ароматичного рядів, альдегідів, кетонів, амінів і ін.
Натрій використовують для остаточної осушки розчинників для видалення слідів води. Розчинники, що містять більше 0,5% води, сушити натрієм не можна — внаслідок бурхливого протікання реакції можливий вибух. Попередньо розчинник повинен бути зневоднений за допомогою безпечного осушувача, наприклад хлориду кальцію або сульфату натрію. При взаємодії натрію з вологою, що міститься в розчиннику, утворюються газоподібний, водень і гідроксид натрію, який покриває поверхню металу тонкої плівкою, що уповільнює або повністю припиняє подальшу реакцію. Щоб підвищити повноту використання натрію, його найчастіше застосовують у вигляді тонкого дроту, що володіє великою питомою поверхнею.
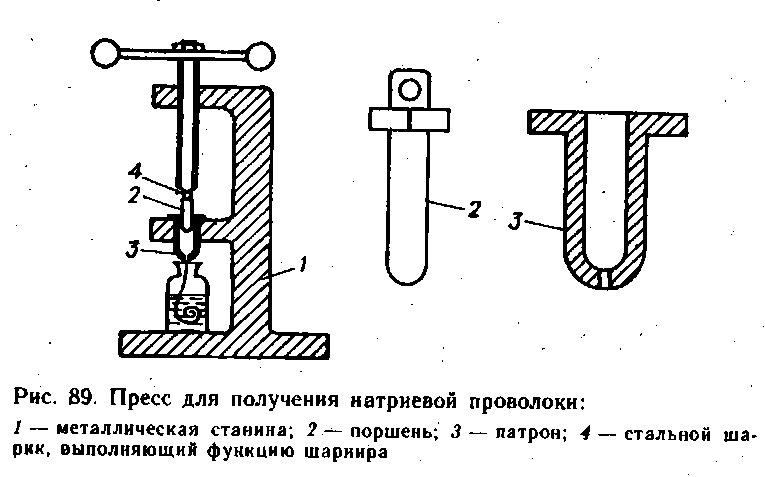
Для отримання натрієвої дроту користуються спеціальним пресом, зображеним на рис. 89. У патрон поміщають невеликі шматки натрію, попередньо очищені від гідроксидні кірки. Патрон вставляють в гніздо преса, до отвору патрона впритул приставляють пляшку з розчинником, і потім, повільно обертаючи гвинт, видавлюють дріт. Після видавлювання всього натрію поршень виймають з патрона, поміщають їх в фарфоровий стакан і заливають етиловим спиртом, щоб розчинити залишки натрію. Після закінчення розчинення поршень і патрон ретельно миють водою і сушать в шафі.
Якщо розчинник передбачається залишити над натрієвої дротом на ніч, не слід закривати посудину притертою пробкою: виділяється водень може створити значний тиск в ємності. У таких випадках необхідно використовувати пробку, забезпечену хлоркальціевой трубкою.
Для прискорення процесу сушіння і більш повного видалення води розчинник кип’ятять близько години в колбі зі зворотним холодильником над натрієвої дротом, після чого переганяють його в сухий приймач, захищений хлоркальціевой трубкою. Не слід забувати, що для нагрівання колби в такому випадку не можна використовувати водяну або гліцеринову баню. Як рідкого теплоносія для лазні рекомендується мінеральне масло. Натрієву дріт, що залишилася після перегонки, знищують в тій же колбі відразу після її охолодження, заливаючи достатньою кількістю етилового спирту. Час, що залишився ‘в колбі невелика кількість розчинника перед знищенням залишків дроту можна не видаляти.
Якщо необхідно отримати дуже сухий розчинник для особливо точних робіт, в перегнаний над натрієм розчинник додають нову порцію дроту, над якою його і зберігають. Критерієм якості осушення служитьповерхню дроту — в сухому розчиннику вона довгий час залишається блискучою. Склянку з сухим розчинником над натрієвої дротом поміщають в металевий контейнер, дно і стінки якого необхідно викласти азбестовим картоном. Зберігають контейнери в окремому ящику для ЛЗР.
абсолютування сплавом калій-натрій, рідким при кімнатній температурі, дёет значні переваги: при легкому струшуванні сплав випливає з оксидної плівки і оголює свіжу поверхню, видалення води з розчинника, при більш енергійному струшуванні сплав розпадається на дрібні кульки — в цьому випадку процес сушіння значно прискорюється. Однак ризик, пов’язаний з використанням сплаву в якості осушувача, навряд чи компенсується цими перевагами. Сплав, так само як і калій, при контакті з повітрям утворює надзвичайно вибухонебезпечний перокснд, що представляє-особливу небезпеку при абсолютнрованіі схильних до утворення пер-оксидів простих ефірів.
Гасіння лужних металів
При виборі способу пожежогасіння слід розрізняти горіння власне лужних металів, горіння водню, що виділяється в процесі взаємодії металу з водою, і горіння органічного розчинника в присутності лужного металу. Найбільш небезпечно, коли загоряється сам лужної метал, хоча такі випадки відбуваються рідко.
Гасіння літію. Серйозну небезпеку становить загорівся металевий літій. Використання звичайних засобів пожежогасіння (вода, піна, діоксид вуглецю, галогенпохідних вуглеводнів) або підсилює горіння, або веде до вибуху. При темпера ‘турі вище 250 ° С літій швидко руйнує скло, кварц, бетону вогнетриви, реагує з піском. Лнтін продовжує горіти в атмосфері азоту і діоксиду вуглецю. Непридатні для гасіння хлорид і карбонат натрію, оскільки при контакті з цими солями палаючий літій витісняє натрій. Не можна застосовувати також порошкові вогнегасники, забезпечені складами ПС (н ПС 2, хоча в багатьох інструкціях їх помилково рекомендують для гасіння всіх лужних металів.
Для гасіння палаючого літію розроблені з п е-соціальні порошкові склади ПС-І , ПС 12 і ПС 13 на основі різних флюсів і графіту з гидрофобизирующими добавками (див. розд. 3.1). Слід використовувати також порошкоподібний графіт, х т о к р і д літій, хлорид калію. При роботі з літієм крім звичайних засобів пожежогасіння необхідно мати напоготові достатню кількість одного з перерахованих порошків.
Літій можна загасити також, витіснивши повітря з вогнища горіння аргоном. Подавати аргон слід так, щоб струмінь газу чи розпилювати рідкий метал. Після припинення горіння залишки металу слід остудити в струмі аргону .
Гасіння натрію, калію до сплаву і атрій-калій. Найкращі результати при гасінні цих металів досягаються шляхом використання вогнегасників, споряджених порошками ПС 1 і ПС 2 (див . розд. 3.1). Порошок повинен повністю покрити поверхню палаючого металу. Горіння припиняється також при засипанні металів дрібним сухим кварцовим піском, кальцинованої содою, дрібної кухонною сіллю. Кухонна сіль краще піску, оскільки при високій температурі натрій і калій можуть реагувати з діоксидом кремнію.
Рекомендований іноді в якості огнегасительного кошти порошкоподібний графіт придатний для гасіння палаючого натрію, але не калію. При горінні калію і сплаву калій-натрій утворюється над-пероксид калію, який реагує з графітом з вибухом. Непридатні для придушення горіння натрію і калію порошкові вогнегасники, заряджені складом ПСБ на основі бікарбонату натрію та складом СІ 2, утримуючи щі м тетр а фторді бро Мета н.
Натрій і калій можна гасити аргоном і азотом. Аргон ефективніше, оскільки істотно важчий за повітря.
Діоксид вуглецю непридатний для гасіння натрію і калію, проте вуглекислотним вогнегасником можна успішно загасити розчинник в присутності натрію. Зазвичай натрій не запалюється, поки не вигорить весь розчинник, так як пари розчинника захищають метал від контакту з киснем повітря. Іноді цей ефект вдається використовувати при гасінні палаючого металу. Якщо на палаючий в будь-якої ємності натрій вилити невелику кількість гасу, що утворився в результаті вогнище полум’я можна повністю загасити за допомогою вуглекислотного вогнегасника.
Лужний метал вважається погашеним тільки після повного охолодження. Незгорілі залишки металу ретельно збирають в товстостінний фарфоровий стакан і знищують звичайним способом.
Як зберігати
Використання і зберігання лужних металів вимагає суворого дотримання особливих правил . Необхідно створити умови, які не допускають їх контакт з повітрям, щоб уникнути вибухів і пожеж.
Зберігають метали лужної групи залитими шаром зневодненого гасу в скляному або фарфоровому ємності, щільно закритій корковою або пластиковою пробкою (не рекомендують використовувати притерті пробки) . Скляні банки поміщають в металевий ящик з піском, обладнаним спеціальними осередками.
Щоб переконатися в придатності гасу для зберігання в ньому лужних металів, проводять якісний аналіз на вологість . Для цього в пробірку з гасом вносять невелику порцію металевого натрію. Наповнювач вважається якісним, якщо не з’явилися пухирці газу (водню). Процес необхідно проводити під витяжкою в лабораторних умовах.

